结节性硬化症最新研究实现了从基因到治疗的全面深入探索。研究不仅揭示了该病症的遗传基础,为早期诊断提供了科学依据,还积极探索了多种创新治疗方法,旨在改善患者的生活质量。这一综合性研究为结节性硬化症的治疗开辟了新路径,有望为患者带来福音。
结节性硬化症(Tuberous Sclerosis Complex, TSC)是一种罕见的常染色体显性遗传性疾病,由TSC1或TSC2基因的失活性突变引起,导致多个器官(包括脑、心脏、肾脏和皮肤)发生错构瘤样损伤,自1880年Bourneville首次描述TSC以来,科学家们对其进行了广泛而深入的研究,近年来,随着基因测序技术和生物医学研究的进步,TSC的发病机制、诊断方法及治疗策略均取得了显著进展,本文旨在综述结节性硬化症的最新研究成果,从基因发现到治疗策略的全面探索。
基因研究进展
TSC的致病基因主要包括TSC1(位于染色体9q34)和TSC2(位于染色体16p13.3),这两个基因编码的蛋白Hamartin和Tuberin是mTOR信号通路的关键负调控因子,TSC1或TSC2基因的失活导致mTOR信号通路过度激活,进而引发细胞生长、分化和增殖的异常,最终导致多器官受累的临床表现。
最新的基因研究发现,TSC基因突变类型超过1600种,其中TSC-2基因突变更为常见,约占73%的患者,TSC-1突变以小片段突变为主,而TSC-2突变则包括大片段缺失、基因重排、小片段突变和错义突变等多种类型,值得注意的是,TSC-2基因突变的患者往往表现出更严重的病程和更早出现的症状,这可能与mTOR信号通路过度激活的程度有关。
研究人员还发现,PKD基因的突变与TSC2突变并存时,患者发生多囊肾病的风险显著增加,且病程更为急迫,这些发现不仅加深了我们对TSC发病机制的理解,也为临床诊断和治疗提供了重要依据。
病理与临床表现
TSC的临床表现多样,涉及多个器官系统,神经系统症状最为常见,约90%的患者出现癫痫,且多为药物难治性癫痫,TSC患者的脑部主要病理损害包括皮层结节、白质放射状移行线、室管膜下钙化灶和室管膜下巨细胞星形细胞瘤(SEGA),SEGA是TSC患者发病和死亡的主要原因之一,尤其在儿童和青少年中更为突出。
除了神经系统症状外,TSC患者还可能出现皮肤病变(如皮脂腺瘤、低黑素斑等)、肾脏并发症(如血管平滑肌脂肪瘤、多囊肾等)、心脏受累(如横纹肌瘤)以及肺淋巴管肌瘤病等,这些临床表现的多样性和复杂性给TSC的诊断和治疗带来了巨大挑战。
诊断标准的更新
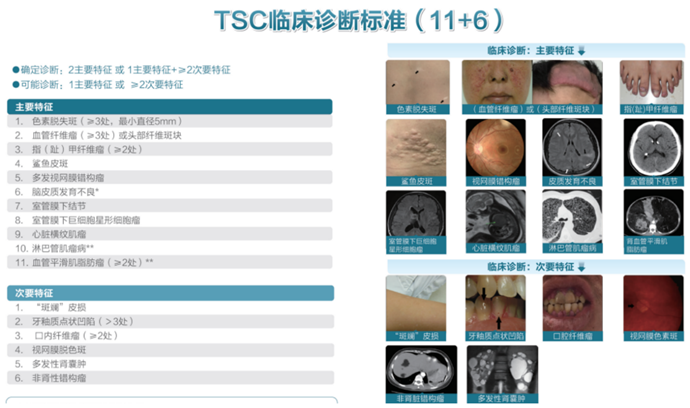
随着对TSC认识的深入,其诊断标准也经历了多次修订,目前,TSC的诊断主要依据临床表现和基因检测结果,2012年国际TSC共识小组提出了新的诊断标准,将诊断分为确定诊断和可能诊断两类,确定诊断需要至少满足2项主要指标或1项主要指标加2项次要指标;可能诊断则需要满足1项主要指标或2项次要指标。
主要指标包括色素脱失斑、面部血管纤维瘤、指(趾)甲纤维瘤、鲨鱼皮样斑、多发性视网膜错构瘤、脑皮层发育不良、室管膜下结节、SEGA、心脏横纹肌瘤、淋巴血管肌瘤病和血管平滑肌脂肪瘤等,次要指标则包括“斑斓”皮损、牙釉质点状凹陷、口内纤维瘤、视网膜色素脱失斑、多发性肾囊肿和非肾性错构瘤等。
基因检测结果也是诊断TSC的重要依据,致病性突变(已报道致病突变或功能证实TSC基因突变并影响TSC1/2复合体的功能)可作为独立的诊断标准,需要注意的是,基因突变检测阴性并不能排除TSC的诊断,因为存在非致病性突变的可能性。
治疗策略的进展
TSC的治疗策略主要包括药物治疗、手术治疗和基因治疗等,药物治疗方面,mTOR抑制剂的应用为TSC的治疗带来了新的希望,mTOR抑制剂通过抑制mTOR信号通路的过度激活,从而减缓细胞生长和增殖,达到治疗TSC相关肿瘤和症状的目的,目前,已有多种mTOR抑制剂(如西罗莫司、依维莫司等)被批准用于TSC相关癫痫和SEGA的治疗。
手术治疗方面,SEGA的切除一直是TSC患者的重要治疗手段,随着mTOR抑制剂的应用,手术治疗的时机和方式也发生了变化,对于部分SEGA患者,药物治疗可能成为首选方案,尤其是对于年龄较小或症状较轻的患者,随着神经外科技术的进步,微创手术和立体定向放射外科等新技术也为TSC患者的治疗提供了更多选择。
基因治疗方面,尽管目前仍处于研究阶段,但已显示出巨大的潜力,通过基因编辑技术(如CRISPR-Cas9)修复TSC1或TSC2基因的突变,有望从根本上治愈TSC,基因治疗面临诸多挑战,包括基因递送效率、免疫原性和安全性等问题,需要进一步研究和探索。
最新研究成果:大脑类器官模型的应用
近年来



 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号
还没有评论,来说两句吧...